在進(jìn)行藥品注冊時,不同的藥品,有不同的注冊流程,今天小譯就給大家介紹專利藥、原研藥和仿制藥三種藥品及其注冊流程。
專利藥
專利藥(創(chuàng)新藥),即在全球最先提出申請,并獲得專利保護(hù)的藥品,一般有20年的保護(hù)期,其他企業(yè)不得仿制。
專利藥物是指具有自主知識產(chǎn)權(quán)的藥物。相對于仿制藥,專利藥強調(diào)藥品化學(xué)結(jié)構(gòu)新穎或有新的治療用途,且在以前的研究文獻(xiàn)或?qū)@校匆妶蟮肋^。
下面是創(chuàng)新藥的研發(fā)流程示意圖:
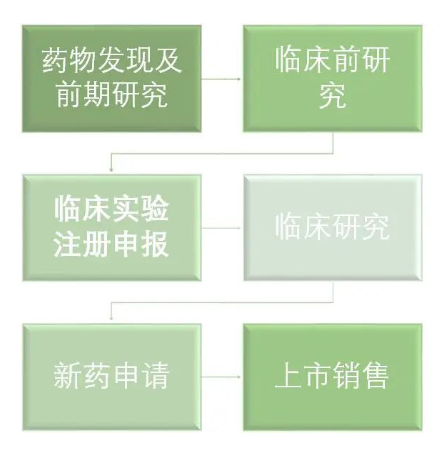
雖然從示意圖上看起來比較簡單,但是藥物前期發(fā)現(xiàn)和研究一般都要耗費幾年時間,臨床實驗也分Ⅰ期,Ⅱ期,Ⅲ期,Ⅳ期,這也要耗費3-7年的時間。
2.原研藥
原研藥,即過了專利期的、由原生產(chǎn)商生產(chǎn)的藥品。
下面是原研藥的研發(fā)流程:
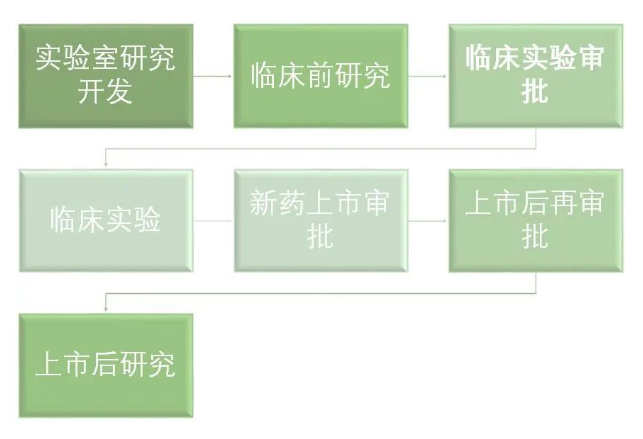
原研藥的研發(fā)時期與創(chuàng)新藥一樣,耗時比較長,一般要花費10-15年,花費金額也十分巨大,一般由研發(fā)實力雄厚的大型制藥企業(yè)發(fā)起。
3.仿制藥
仿制藥,即專利藥過了保護(hù)期,其他企業(yè)均可仿制的藥品。
仿制藥與原研藥在劑量、效力、作用以及適應(yīng)癥上相同或趨同。但是仿制藥并不是山寨藥,在國際市場上,各國對仿制藥都有著同樣嚴(yán)格的要求。
下面是仿制藥的研發(fā)流程:
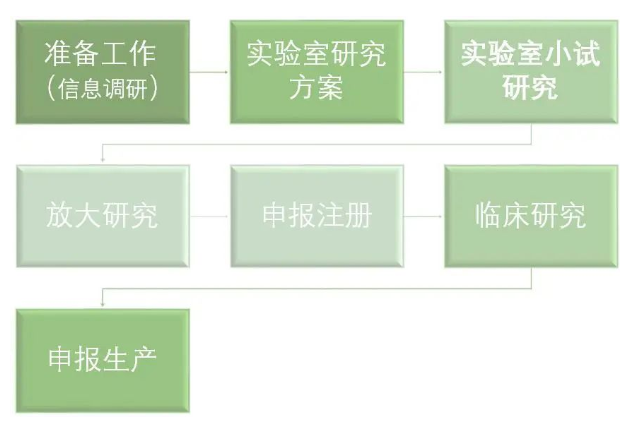
仿制藥的研發(fā)流程則相對簡單很多。通常只需以原研藥為參考,研究探索藥品合成方法,簡略進(jìn)行臨床試驗,在符合相關(guān)標(biāo)準(zhǔn)規(guī)定以后,即可上市。總的研發(fā)時間一般10-13個月。
不管什么藥品,研究開發(fā)、臨床試驗都是重要的過程。一個藥品從研發(fā)到上市需要強大的資金、技術(shù)支持和大量的時間,所以任何一個環(huán)節(jié)都十分重要,都不能出錯。
藥品中美雙報,譯國譯民助力
部分國內(nèi)企業(yè)在引進(jìn)國外原研藥進(jìn)行研究開發(fā)時,有大量外語資料和文件,譯國譯民集團(tuán)可以為客戶提供早期研發(fā)、臨床研究、注冊申報、上市后檢測數(shù)據(jù)等全流程的醫(yī)學(xué)語言翻譯服務(wù);同時還提供增值服務(wù):在報送藥監(jiān)局時使用eCTD電子通用技術(shù)文檔。
覆蓋藥品注冊中美雙報全流程
早期研發(fā)、實驗室研究、臨床研究注冊申報、上市后監(jiān)測數(shù)據(jù)等全流程的醫(yī)學(xué)語言翻譯服務(wù)。
全球業(yè)務(wù)服務(wù)覆蓋
業(yè)務(wù)覆蓋中國大陸、港澳臺、東南亞、歐洲、北美、南美等地區(qū),通過語言服務(wù)這座橋梁,打破國內(nèi)外醫(yī)學(xué)交流壁壘,促進(jìn)醫(yī)學(xué)前沿知識的全球化普及。
支持多種語言互譯
中文、英文、日語、韓語、德語、法語、西班牙語等72+語種。
支持多種文件格式
DOCX、DOC、XLSX、XLS、TXTPPTX、PPT、PDF、XML......
我們的優(yōu)勢:
嚴(yán)格的保密措施集團(tuán)通過了ISO27001信息安全管理體系認(rèn)證,建立合作后,與客戶簽訂保密協(xié)議,翻譯流程全流程監(jiān)督管理,多重保密措施加持。
嚴(yán)控流程,安全可靠
嚴(yán)謹(jǐn)?shù)墓P譯交付標(biāo)準(zhǔn)生產(chǎn)作業(yè)流程:需求分析-譯前處理-譯員匹配-培訓(xùn)-里程碑分解-稿件派發(fā)-翻譯-審校-質(zhì)檢-交付。由醫(yī)學(xué)行業(yè)專屬項目經(jīng)理全流程監(jiān)控,保證項目高質(zhì)高效完成交付。 快速響應(yīng),及時交付
譯國譯民集團(tuán)在上海、福州、北京、深圳、武漢、西安、貴陽、香港等地均設(shè)有公司,支持客戶線下考察。客戶經(jīng)理7*24小時快速響應(yīng),高效解決客戶項目需求。
終身質(zhì)保,售后無憂
全方位解決翻譯過程所遇到的專業(yè)問題,終身質(zhì)保。為長期客戶建立專屬語料庫和術(shù)語庫,不斷貼合客戶語言表達(dá)習(xí)慣,向客戶交付高質(zhì)量的醫(yī)學(xué)稿件。
